QIAwave Plasmid Miniprep Kit (50)
Cat. No. / ID: 27204
Features
- Qualität und Leistung der Plasmid-DNA identisch mit dem QIAprep Spin Miniprep Kit
- Bis zu 22 % weniger Kunststoff und bis zu 14 % weniger Karton im Vergleich zum QIAprep Spin Miniprep Kit
- Wiederverwendbare Abfallröhrchen aus 100 % recyceltem Kunststoff
- Pufferkonzentrate, die bis zu 93 % weniger Kunststoff verbrauchen als unsere Standardpuffer
Product Details
Das QIAwave Plasmid Miniprep Kit ist umweltfreundlicher als unser Standard QIAprep Spin Miniprep Kit, denn es verbraucht bis zu 22 % weniger Kunststoff und bis zu 14 % weniger Karton. Es enthält Abfallröhrchen aus 100 % recyceltem Kunststoff, die Sie während des gesamten Verfahrens wiederverwenden können. QIAwave Puffer werden als Konzentrate bereitgestellt, was die Kunststoffmenge pro Flasche um bis zu 93 % reduziert. Um Papier zu sparen, enthält das Kit keine ausgedruckten Protokolle. Sie können die Protokolle herunterladen oder den QR-Code in der Kit-Verpackung scannen. Obwohl Verpackung und Komponenten unseres QIAwave Kit anders aussehen, sind einfache Handhabung, Chemie und Ergebnisse identisch zum Standard-Kit.
Wichtig: Für die Lagerung der rekonstituierten Puffer benötigen Sie sterile Glasflaschen.
Gemeinsam mit My Green Lab haben wir die Umweltverträglichkeit dieses Kits untersucht. Die My Green Lab ACT-Label wurden für die Produktbewertung und -einstufung anhand mehrerer Nachhaltigkeitskriterien entwickelt, u . a.:
• Herstellung
• Verantwortungsvoller Umgang mit Chemikalien
• Nachhaltige Inhaltsstoffe bei Produkten und Verpackungsmaterialien
• Entsorgung der Verpackung am Ende des Lebenszyklus
Die Produkte werden von 1–10 bewertet, mit Ausnahme des Energie- und Wasserverbrauchs mit 1 Punkt/kWh bzw. Gallone (3,785 Liter). Je niedriger die Punktzahl, desto geringer die Umweltbelastung (siehe Abbildungen „QIAwave Plasmid Miniprep Kit ACT Umweltverträglichkeitslabel USA 50/ 250, EU 50/ 250 und UK 50/ 250“).
Mit dem QIAwave Plasmid Miniprep Kit lassen sich bis zu 20 μg hochreiner Plasmid- oder Cosmid-DNA für molekularbiologische Routineanwendungen isolieren, wie z. B. fluoreszenz- und radioaktivitätsbasierte Sequenzierung und Klonierung. Mit dem QIAprep High-Yield Supplementary Protocol sind sogar noch höhere Ausbeuten (≤30 μg) möglich. Für optimale Ergebnisse empfehlen wir die Kombination mit dem QIAvac 24 Plus.
See figures
Performance
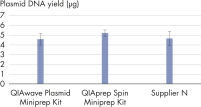
Die Leistung unseres QIAwave Plasmid Miniprep Kits und des QIAprep Spin Miniprep Kits ist identisch, da die Chemie die gleiche ist. Wir konnten zudem zeigen, dass beide Kits die Wettbewerberprodukte übertreffen (siehe Abbildung „ Leistung des QIAwave-Kits“).
Mit dem QIAwave Plasmid Miniprep Kit lassen sich bis zu 20 μg Plasmid-DNA oder Cosmid-DNA in molekularbiologischer Qualität aufreinigen, um sie in molekularbiologischen Routineanwendungen wie PCR, Sequenzierung und Klonierung einzusetzen.
Die QIAprep 2.0 Spin-Säulen sind so vielseitig, dass sie in Mikrozentrifugen, auf Vakuumgeräten und auf dem QIAcube Connect verwendet werden können (siehe Abbildungen „Handhabungsoptionen für QIAprep 2.0 Spin-Säulen: Mikrozentrifuge, Vakuumgerät und automatisiertes System“). Das Vakuumverfahren vereinfacht die Handhabung und beschleunigt die Bearbeitung von Proben. Die QIAprep 2.0 Spin-Säulen können auch mit dem QIAvac 24 Plus oder jedem anderen handelsüblichen Vakuumgerät mit Luer-Anschlüssen bearbeitet werden.
| Format | Spin-Säulen |
| Aufreinigungsmodul | QIAprep 2.0 Spin Columns |
| Durchsatz | 1–24 Proben |
| Vorbereitungszeit | 24 Minipräps in 30 Minuten |
| Erforderliche Arbeitsmittel | Mikrozentrifuge oder Vakuumverteiler; vollständig automatisierbar mit QIAcube Connect |
| Lysatbereinigung | Zentrifugation |
| Fassungsvermögen des Säulenreservoirs | 800 µl |
| Minimales Elutionspuffervolumen | 50 µl |
| Kulturvolumen für Plasmide mit hoher Kopienzahl | 1–5 ml |
| Kulturvolumen für Plasmide mit geringer Kopienzahl/Cosmide | 1–10 ml |
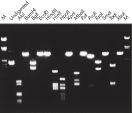
Aufgereinigte DNA kann für den Restriktionsverdau verwendet werden (siehe Abbildung „ Kompletter Verdau mit verschiedenen Restriktionsenzymen“).
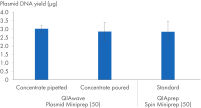
Wir haben auch die Ausbeuten an Plasmid-DNA verglichen, die mit dem QIAwave Plasmid Miniprep Kit (50) Puffer, hergestellt durch Gießen oder Pipettieren, und den QIAprep Spin Miniprep Kit (50) Standardpuffern erzielt wurden. Beide Methoden ergeben vergleichbare Ausbeuten, wie aus Abbildung “ Handhabung von Pufferkonzentraten” ersichtlich.
See figures
Principle
Die QIAprep 2.0 Spin Columns enthalten eine einzigartige Silikamembran, die bei Vorliegen einer hohen Konzentration an chaotropem Salz bis zu 20 μg DNA bindet und die Elution in einem kleinen Volumen salzarmen Puffers ermöglicht. Mit der QIAprep Membrantechnologie entfallen die zeitaufwändige Phenol-Chloroform-Extraktion und die Alkoholausfällung sowie die Probleme und Nachteile, die mit losen Harzen und Aufschlämmungen einhergehen. Die aus den QIAprep 2.0 Spin Columns eluierte hochreine Plasmid-DNA ist sofort einsatzbereit und muss nicht ausgefällt, konzentriert oder entsalzt werden.
Procedure
Die Aufreinigung von DNA-Plasmiden mit dem QIAwave Plasmid Miniprep erfolgt nach einem einfachen Verfahren zum Binden, Waschen und Eluieren (siehe Flussdiagramm „ QIAwave Plasmid Miniprep Verfahren“).
1. Die Bakterienkulturen lysieren und die Lysate durch Zentrifugation bereinigen.
2. Die bereinigten Lysate in die QIAprep 2.0 Spin Columns einbringen. An diesem Punkt adsorbiert die Plasmid-DNA an der Silikamembran und Verunreinigungen werden weggewaschen.
3. Die reine DNA wird dann in einem kleinen Volumen Elutionspuffer oder Wasser eluiert.
Neben der Aufreinigung der Plasmid-DNA aus E. coli kann das QIAwave Plasmid Mini Kit auch zur Aufreinigung von Plasmid-DNA aus Saccharomyces cerevisiae, Bacillus subtilis und Agrobacterium tumefaciens verwendet werden. Sollten Sie Protokolle für diese Anwendungen benötigen, wenden Sie sich bitte an unser Team des technischen Kundendienstes oder an Ihren Händler vor Ort.
QIAwave Puffer werden als Konzentrate geliefert und lassen sich durch Zugabe von Wasser und/oder Ethanol leicht rekonstituieren; Einzelheiten entnehmen Sie bitte dem Handbuch. QIAwave QIAprep 2.0 Spin Columns und Waste Tubes werden einzeln verpackt geliefert und müssen vor Protokollbeginn vormontiert werden. Das kostet zwar etwas mehr Zeit, reduziert aber den Plastikmüll.
Das QIAwave Plasmid Miniprep Kit kann auf dem QIAcube Connect mit den QIAprep Spin Miniprep Kit Protokollen automatisiert werden.
See figures
Applications
Das QIAwave Plasmid Miniprep Kit liefert reproduzierbare Ausbeuten an hochreiner DNA, die sich für die meisten Anwendungen eignet, einschließlich:
- PCR
- Restriktionsaufschluss
- Ligation und Transformation
- Sequenzierung
- Screening
Supporting data and figures
QIAwave Plasmid Miniprep Kit (250) US ACT Umweltverträglichkeitslabel.
ACT-Umweltverträglichkeitslabel wurden für die Bewertung und Einstufung von Produkten anhand mehrerer Nachhaltigkeitskriterien entwickelt. Die Produkte werden mit 1 bis 10 Punkten bewertet, mit Ausnahme des Energie- und Wasserverbrauchs, der mit 1 Punkt je kWh bzw. Gallone (3,785 Liter) bewertet wird. Je niedriger die Punktzahl, desto geringer die Umweltbelastung.

Specifications
| Features | Specifications |
|---|---|
| Applications | Fluoreszenz- und radioaktive Sequenzierung (einschließlich Kapillarsequenzierung), Ligation, Klonierung, Transformation etc. |
| Processing | Manuell (Zentrifugation oder Vakuum) |
| Plasmid type | High-Copy, Low-Copy, Cosmid-DNA |
| Culture volume/starting material | 1–10 ml Kulturvolumen |
| Elution volume | 50 µl (Minimum) |
| Technology | Silikatechnologie |
| Time per run or prep per run | <30 Minuten |
| Yield | <20 ug |
| Samples per run (throughput) | 1–24 Proben pro Lauf |
| Number of preps per run | 1–24 Proben pro Lauf |